OBSERVACIONES.
Dibuja todos los pasos empleados en el sembrado de las
placas de petri y los resultados de las colonias bacterianas que
crecieron.
CONCLUSIONES:
_______________________________________________________________________________________
Práctica Nº 05
Nombre del Alumno:_________________________________
Grupo______
Profesor de Laboratorio_______________________________
Calif:_______
PRÁCTICA
Nº 06
Estudio de
hongos
OBJETIVO:
Aislar hongos ambientales de un establecimiento de
salud mediante el método de exposición en
placaRealizar preparaciones en fresco y en cinta adhesiva
de distintas especies de mohos.Observar la morfología de los hongos y
distinguir entre hifas septadas y no septadas y entre
distintos tipos de esporas y las estructuras que las
originan
MATERIAL
Ambientes de un establecimiento de salud
4 placas con medio de cultivo estéril de Agar
SabouraudLupas
1 varilla de vidrio doblada
Asa bacteriológica
Alcohol al 70%
Microscopio
Porta y cubreobjetos (22×22 mm) limpios y
desengrasados con alcoholSolución de lactofenol al azul
algodónCinta adhesiva transparente
INTRODUCCION
Los hongos no son plantas ni animales, aunque se
parezcan en algunas de sus características tanto a las
unas como a los otros. A las plantas, por ser organismos
sedentarios que se encuentran fijos a un sustrato y, mientras
están vivos, no cesan de crecer. A los animales, pues,
aunque las células de los hongos poseen pared como las de
las plantas, las paredes celulares fúngicas son ricas en
quitina, la misma sustancia que hace duro el esqueleto externo de
los insectos.
En realidad, los organismos que conocemos como hongos
tienen diferentes orígenes en el árbol de la vida,
razón por la cual conforman el reino de los hongos
(Fungi o Eumycota).
Se estima que existe más de un millón de
especies de hongos en el planeta, pero tan sólo unas
70,000 de ellas han sido descritas por los especialistas, lo cual
hace evidente la necesidad de contar con más
científicos (micólogos) que estudien estos
organismos. Mientras tanto, muchas especies de hongos se han
extinguido y otras se encuentran amenazadas en todo el
mundo.
Los hongos tienen distintos hábitos de vida. Los
hongos saprófitos, es decir descomponedores de materia
orgánica, cumplen una función ecológica de
la mayor relevancia pues garantizan el reciclaje de la materia
muerta y, por lo tanto, la recirculación de sustancias
nutritivas en los ecosistemas. Los hongos parásitos, que
viven sobre o dentro de otros seres vivos, obtienen su alimento
de éstos y llegan a producir enfermedad en su hospedero.
Los hongos simbiontes que se asocian de manera mutualista con
otros organismos constituyen alianzas vivas de beneficio mutuo
como por ejemplo los líquenes (asociación de hongo
y alga) y las micorrizas (asociación de hongo y
raíz de una planta), simbiosis estas de gran importancia
en la naturaleza en procesos de colonización de
hábitats y de circulación de nutrientes.
Desde la perspectiva económica, los hongos
ofrecen múltiples servicios, pues se utilizan como
alimentos, levaduras de la masa de pan, fermentadores en la
producción de vino y cerveza, en la maduración de
quesos y en el control biológico de plagas
agrícolas. Además, como fuentes de sustancias que
por su actividad biológica pueden ser de enorme utilidad
en medicina y en la bioindustria (ej. antibióticos) y como
agentes para estimular el desarrollo de las plantas (hongos
formadores de micorriza). Sin embargo, también son
dañinos cuando actúan como parásitos de
plantas y animales o cuando estropean estructuras de madera,
alimentos almacenados, libros y hasta obras de arte, amén
de ser peligrosos si, por desconocimiento, se consumen aquellos
que tienen principios tóxicos o
alucinógenos.
PROCEDIMIENTO
AISLAMIENTO DE HONGOS AMBIENTALES
Debes tener tus placas de petri con Agar Sabouraud a
la que se añadió antibiótico para evitar
el crecimiento de microorganismos diferentes a los
hongosCon la compañía de tu profesor
supervisor, acude a un ambiente asistencial del
establecimiento de salud.Cuando te encuentres en dicho ambiente, saca tu
placa petri y colócala sobre la superficie de una
mesaLuego, abre la tapa de placa y déjala en
exposición por espacio de 2 minutosTranscurrido el tiempo, tápala nuevamente y
rotula las placas de petri el nombre del servicio
asistencialHaz el mismo procedimiento con otras placas y en
diferentes servicios del establecimiento de salud, anotando
siempre el nombre del ambienteLuego, traslada tus placas al laboratorio y
déjalas incubando a temperatura de 30°C por 3 o
más díasObserva el crecimiento de colonias de
hongos
ESTUDIO MICROSCÓPICO
Preparación en cinta adhesiva
Técnica
Coloca sobre un portaobjetos una gota de
solución de lactofenol no demasiado grande.Corta un trozo de cinta adhesiva transparente de
aproximadamente 2cm.Toca con el lado adhesivo de la cinta la superficie
de la fruta o el pan enmohecido o el borde de una colonia de
hongo de un cultivo. En la zona central de una colonia puede
haber una excesiva concentración de
esporas.Pega la cinta adhesiva sobre la gota del
portaobjetos.Elimina el colorante sobrante con un papel de
filtro.
CUESTIONARIO
1. ¿Qué es un hongo?
_________________________________________________________
2. ¿Por qué los hongos que causan micosis
cutánea se llaman queratinofílicos?
_____________________________________________________________________________________
3. Menciona 4 hongos causantes de micosis
subcutánea en los humanos
______________________________________________________________________________________
4. ¿Debido a qué Candida albican
es conocido como un hongo causante de micosis
oportunista?
_______________________________________________________________________________
5. Menciona la forma de prevención de las micosis
cutáneas
___________________________________________________________________________________
6. ¿Por qué se añade
antibiótico al medio de cultivo para aislar
hongos?
____________________________________________________________________________________________
OBSERVACIONES
Dibuja todo el proceso llevado a cabo para el
aislamiento de hongos, así como los resultados
obtenidos.




CONCLUSIONES
_____________________________________________________
Práctica Nº 06
Nombre del Alumno:_________________________________
Grupo______
Profesor de Laboratorio______________________________
Calif: _______
PRÁCTICA
Nº 07
Aislamiento de
bacterias patógenas de heridas y
secreciones
OBJETIVO:
Demostración de la presencia de bacterias
patógenas en la piel y garganta, mediante el método
de siembra en placa.
MATERIAL
Placas de petri con Agar- Sangre (GS)
Placas de petri con Manitol sal Agar
(MSA)Placas de petri con Agar vogel y Jonson
(AVJ)Solución salina estéril
Exudado faríngeo
Raspado de piel
Mechero
Asa de platino
Hisopos estériles
INTRODUCCIÓN
La piel (en condiciones normales) es una barrera que
impide la penetración de los gérmenes, por ello
actúa como mecanismo de defensa. Los mamíferos son
frecuentemente infectados por algunas de las bacterias
preexistentes en su medio ambiente, aunque en general viven en
equilibrio con estos microorganismos, manteniéndoles
limitados a zonas relativamente superficiales de su organismo.
Sin embargo las bacterias infecciosas producen enfermedades al
invadir tejidos más profundos. Por lo tanto para mantener
la salud, el huésped debe defenderse constantemente frente
a la invasión por parte de las bacterias.
Los factores mecánicos, químicos y
microbianos desempeñan un papel importante al restringir
la colonización de las bacterias a las superficies
corporales.
Factores mecánicos: Las superficies
epiteliales de la piel y de las mucosas constituyen barreras que
resultan más o menos impermeables a las bacterias. La
impermeabilidad de la piel es mayor que en la mayoría de
las mucosas. Cuando se altera la integridad de la superficie
epitelial, pueden desarrollarse infecciones subcutáneas.
Las bacterias que causan más frecuentemente estas
infecciones son las que existen habitualmente en la superficie
cutánea, folículos pilosos y glándulas
sudoríparas en la piel, es decir los
estafilococos.
Factores químicos: La acidez de las
secreciones gástricas mantienen sin duda la esterilidad
habitual del estómago. El pH bajo de la piel (3-5), debido
en gran parte a los productos ácidos del metabolismo
bacteriano, frena sin duda el crecimiento de muchos
microorganismos que toman contacto con sus superficie
Factores microbianos: El antagonismo microbiano
inhibe el crecimiento de muchas bacterias y hongos potencial
mente patógenos en lugares superficiales donde de no ser
así, podrían producirse enfermedades.
La flora de la región faríngea presenta
problemas peculiares para el aislamiento e identificación
de microorganismos, por lo tanto se refiere a los componentes de
la flora normal como a microorganismos con acción
patógena. Es importante recordar que algunos
microorganismos tienen capacidad patógena definida y su
presencia es un indicio claro de enfermedades, en tanto que
otros, llamados oportunistas, guardan una posición ambigua
y pueden encontrarse tanto como componentes de la flora normal,
como asociados a procesos patológicos, causados por otros
microorganismos que son verdaderos responsables (por ejemplo los
virus) Los estafilococos están entre las primeras
bacterias que se reconocieron como patógenas, y se
descubrieron por primera vez a principios de la década
de1880.
Se encuentran ampliamente distribuidos por la
naturaleza, y a menudo forman parte de la flora bacteriana de la
piel y el tracto respiratorio superior; muchas de las especies
que se encuentran en el hombre son comensales. La especie
predominante patógena para el hombre es el
Staphylococcus aureus, constituye la causa más
común de las infecciones supurativas para el hombre. El
aislamiento de S. aureus a partir del exudado
faríngeo y exudado de piel, no tiene importancia
diagnóstica, ya que se considera parte de la flora normal
de la faringe y nasofaringe, por lo que no tiene significado
clínico.
PROCEDIMIENTO:
Limpia y esteriliza el área a trabajar con
fenol al 5%Prende el mechero cerca de donde se va a trabajar,
si es posible coloca otroHumedece el hisopo en solución salina
estéril, pásalo sobre la superficie de la piel
(con o sin pelo)Descarga el hisopo en tres placas de petri con el
medio ya preparado. (Es recomendable que para cada dos placas
se utilice un solo hisopo con muestra). No retires
completamente las tapas de los medios de cultivo para evitar
que se contaminenQuema el hisopo y deséchalo.
Esteriliza el asa de platino hasta el rojo vivo,
enfríalo introduciéndolo en un extremo del
AgarRealiza el sembrado de los microorganismos por el
método de estría utilizando el asa y como se
muestra en la figura. Evita destapar completamente la tapa de
los medios de cultivo.Incuba a 37ºC por 24-48 horas y observa los
resultados.Repite el mismo procedimiento pero ahora toma
muestra de la faringe con hisopos estériles en las
zonas afectadas como: amígdalas, pared posterior de la
faringe, en general cualquier área que manifiesta
signos de inflamación, exudados y úlceras,
procurando no tocar con el hisopo la lengua.
INTERPRETACIÓN DE
RESULTADOS:A) REACCIONES POSITIVAS EN DISTINTOS
MEDIOSAGAR SANGRE
Para el aislamiento, cultivo y detección de
actividad hemolítica de Staphylococcus, Streptococcus
y otros microorganismos exigentes. Se observan colonias
blancas casi grises, grandes, convexas de consistencia
butirácea, Presentan bordes regulares. Se observa que
presenta hemólisis. Las colonias en medio
sólido son redondeadas, uniformes, estos crecen
rápidamente a 37ºC pero tienden a formar
pigmentos mejor a temperatura ambiente
(20ºC).MANITOL SAL AGAR (MSA)
Se utiliza como medio selectivo, para cultivar y
enumerar especies clínicas de estafilococos El manitol
cuando es utilizado por los microorganismos, vira de su color
original rojo a amarillo. Se observan colonias chicas,
blancas, convexas, de consistencia butirácea,
presentan bordes irregulares. S. aureus forma
colonia amarilla, S. Epidermidis, colonia
incoloraAGAR VOGEL Y JONSON (AVJ)
Para la detección de Staphylococcus
aureus coagulasa-positivo, se observan colonias negras
pequeñas, bordes irregulares con halo amarillo. Para
S. epidermidis y otros pequeñas,
negro-grisáceos, sin halo, el medio presenta un vire
de rojo pálido a amarillo.B) DESCRIPCIÓN DEL TIPO DE COLONIAS
OBTENIDASObservar las colonias obtenidas y describirlas
teniendo en cuenta las siguientes
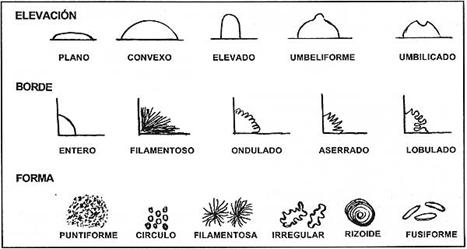
características:FORMA: Puntiforme, circular, rizoide,
irregular, filamentosa.TAMAÑO: Grande (más de 3 mm.),
mediana (2-3 mm.), pequeña (1-2 mm.)COLOR. Reportar el color final después
de la incubaciónBORDE: Entero, ondulado, lobulado,
filamentoso, ondeadoELEVACIÓN: Plano, elevado, convexo,
pulvinado, umbonadoSUPERFICIE: Suave, brillante, rugosa,
plegada, seca, polvorienta
CUESTIONARIO:
1. Explica a qué se debe que las bacterias
son conocidas como piógenas__________________________________________________________________________________
2. ¿Qué tipo de bacterias son
encontradas con mayor frecuencia en quemaduras?______________________________________________________________________________________
3. ¿Qué finalidad tiene humedecer el
hisopo con solución salina estéril?________________________________________________________________________________________
4. ¿Qué son hemolisinas y cuantos
tipos hay?__________________________________________________________________________________________
5. ¿Qué es la infección
intrahospitalaria?_______________________________________________________________________________________
6. ¿Qué otros patógenos pueden
encontrarse en heridas?________________________________________________________________________________________
7. Después de haber incubado a 37ºC por
48 horas describe las colonias obtenidas en cada medio de
cultivo utilizadoGELOSA SANGRE MANITOL SAL AGAR
(MSA).FORMA: FORMA:
.TAMAÑO:
TAMAÑO:.COLOR. COLOR:
.BORDE: BORDE:
.ELEVACIÓN:
ELEVACIÓN:AGAR VOGEL Y JONSON (AVJ) ESTAFILOCOCO
S110.FORMA: FORMA:
.TAMAÑO:
TAMAÑO:.COLOR. COLOR:
.BORDE: BORDE:
.ELEVACIÓN:
ELEVACIÓN:OBSERVACIONES
Dibuja y colorea todos los resultados obtenidos
después de las 48 horas de haber sido
incubados.CONCLUSIONES:
__________________________________________________________________________________________
Práctica Nº 07
Nombre del Alumno:_________________________________
Grupo______Profesor de Laboratorio____________________________
Calif:________PRÁCTICA
Nº 8Aislamiento
de patógenos en infección
urinariaOBJETIVOS
Que los alumnos conozcan los patógenos
causantes de infección urinaria.Presenciar la técnica que se utiliza para
el urocultivo.Interpretar dicha técnica
MATERIAL
Muestra de orina
Tubos con solución salina
fisiológica estéril (9 ml)Agar Tripticase Soya
Agar Eosina Azul de Metileno (EMB)
Agar Mac Conkey
Pipetas de 1 ml estériles
Placas Petri estériles
Asa de Kolle
Mechero
INTRODUCCIÓN
La ITU es una de las enfermedades más
frecuentes, que consiste en la infección por
algún agente patógeno (bacterias con mayor
frecuencia), de cualquiera de los segmentos del aparato
urinario: riñones, uréteres, vejiga o
uretra.PIELONEFRITIS: es la infección del
riñón.URETERITIS: es la infección de uno o
de los dos uréteres.CISTITIS: es la infección de la
vejiga.URETRITIS: es la infección de la
uretra.A las Pielonefritis se les conoce también
como Infecciones del Tracto Urinario Alto. A las Cistitis y
Uretritis también se les conoce como infecciones del
Tracto Urinario BajoLas Ureteritis son generalmente una extensión
de la infección en el riñón o en vejiga
(Cistitis).FACTORES PREDISPONENTES A UNA ITU
El sexo femenino, porque la longitud de
la uretra femenina es pequeña, y se favorece que
las infecciones asciendan desde la región
perineal.Los varones que tienen la próstata
aumentada de tamaño, porque se tiende a
retener la orina debido a que la próstata
aumentada de tamaño genera obstrucción
parcial o total en el segmento que corresponde a la
uretra.Uso de ropas ajustadas, predispone
a desarrollar infecciones urinarias por la
presión que ejercen estos que hacen que la orina
refluya hacia el interior de las vías urinarias
favoreciendo la contaminación de estas.La retención voluntaria de la
orina, es importante que una persona use el
uirinario, tan pronto siente ganas de hacerloLas personas que ingieren poca ingesta de
líquidos.Las personas diabéticas, por la
facilidad que tienen para todo tipo de
infección.Aquellos que tienen alguna
malformación congénita de las vías
urinarias.
SÍNTOMAS DE LAS
ITULo fundamental es el ardor al orinar conocido como
disuria, otros síntomas agregados pueden polaquiuria
(orinar varias veces en cantidad menor a lo habitual), dolor
al final de la emisión, fiebre, náuseas,
vómitos, malestar general, dolor lumbar dependiendo de
la localización de la infección. Cuando es una
infección urinaria alta se suele acompañar de
fiebre, malestar general, dolor lumbar, náuseas o
vómitos; mientras que cuando es baja no.Si se trata de una uretritis gonocócica (se
hace únicamente evidente en el varón), que es
una enfermedad de transmisión sexual, se presenta
ardor al orinar y al inicio de la micción se evidencia
una secreción blanquecina maloliente con el color
parecido al de la "leche condensada".UROCULTIVO
EL urocultivo se utiliza para diagnosticar
bacteriuria, la orina constituye un método excelente
para cultivar la mayor parte de microorganismos que infectan
el aparato urinario.La combinación de piuria con bacteriuria
considerable sugiere la presencia de una infección
urinaria.Utilidad Clínica
Cuando los síntomas indican una posible
infección urinaria como: dolor y sensación
de calor al orinar, así como urgencia frecuente de
orinar.Cuando un paciente esta canalizado por largo
tiempo, aunque no muestre síntomas de
infección.En mujeres embarazadas para monitorear cualquier
bacteria en la orina que pueda causar algún
problema al bebé.
PROCEDIMIENTO
Toma de muestra en
mujeresLa muestra debe ser tomada preferentemente en el
Laboratorio. Si ello no es posible, seguir las mismas
instrucciones en su casa.Debe hacerse una antisepsia previa de la zona
genital, por lo tanto debe tener a la mano lo
siguiente:jabón desinfectante
agua hervida o agua estéril
gasa estéril o un paño acabado de
lavarel recipiente para tomar la muestra.
Proceda primero a lavarse las manos y luego
siéntese en el inodoro, lo más hacia
atrás que pueda. Separe los labios genitales con
una mano y mantenga los pliegues separados y proceda a
asearse toda la zona genital con el jabón
desinfectante. Enjuague con abundante agua estéril y
luego seque bien con gasa estéril o con un paño
limpio.Proceda a recoger la orina, destapando
previamente el frasco SÓLO EN EL MOMENTO DE LA
MICCIÓN y sin tocar con los dedos su interior,
coloque la tapa con el lado plano hacia abajo. No toque el
interior del recipiente o de la tapa. Empiece a orinar y
recoja en el frasco, sólo la muestra del chorro del
medio es decir, no debe recoger ni la primera, ni la
última parte del chorro de orina.
Tape muy bien el frasco y rotúlelo con su
nombre.Tráigalo al Laboratorio lo más pronto
posible, en un recipiente con hielo, cuidando de que no se
bote el contenido.Examen cuantitativo
Método de conteo en placa o recuento
de colonias. Introducido por Kass para evitar los riesgos del
cateterismo vesical y diferenciar bacteriuria verdadera de
contaminación, se realiza de la siguiente
manera:Homogeneiza la muestra mediante
agitación.Diluye al 1:10, colocando 1 ml. de orina en 9
ml. de suero fisiológico
estéril.Prepara diluciones al 1:100; 1: 1000 y 1:10 000,
a partir de la dilución al 1:10.Deposita 1 ml. de cada dilución en placas
Petri esterilizadas, sobre las cuales vacía un
tubo de agar tripticase soya, fundido y enfriado a
45°. Mediante rotación suave, distribuye
homogéneamente la siembra.Lleva a incubar todas las siembras a 37ºC
durante 24 a 48 horas.
Para calcular el número de colonias elige
placas que contengan entre 30 y 300 colonias. Contadas
éstas, basta multiplicar su número por la
dilución respectiva para obtener la cuenta
total.Los resultados del estudio cuantitativo se informan
de la siguiente manera:No hubo desarrollo microbiano.
Menos de 10 000 colonias por ml.
Entre 10 000 y 100 000 colonias por
ml.Más de 100 000 colonias por
ml.
Por lo general, las muestras contaminadas tienden a
mostrar cuentas inferiores a 10 000 colonias/ml. Cuando el
recuento revela valores intermedios, entre 10 0000 y 100 000
colonias/ml, el examen debe repetirse. Conviene advertir que
pueden pasar inadvertidas infecciones urinarias verdaderas,
si no se toman en cuenta cuentas inferiores a 100 000
colonias por ml, ya que existen diversos factores que pueden
explicar recuentos bajos en infecciones urinarias verdaderas,
diuresis acentuada, obstrucción uretral, infecciones
crónicas e infecciones por cocos
grampositivos.Examen cualitativo
El estudio cualitativo, que conduce a la
identificación del agente, se realiza mediante la
siembra de la muestra homogeneizada, en placas con agar
eosina azul de metileno (EMB) o MacConkey.La identificación final de los agentes se
hace mediante el estudio de sus propiedades
bioquímicas y características
serológicas. Esto permite establecer relaciones de
identidad entre microorganismos aislados en cultivos
sucesivos o de control, y definir el estado de revivida o de
reinfección. De esto deriva el valor que tiene el
conocimiento del biotipo, del serotipo (particularmente en
E. coli), del piocinotipo (en especial cuando es de
Ps. aeruginosa) y del antibiótico.
Éste último se obtiene al comparar el
antibiograma de cepas aisladas de muestras obtenidas de
diferentes oportunidades en un mismo paciente Si existe
correspondencia, se concluye que se trata de una misma
cepa.CUESTIONARIO
1. ¿Qué tipos de bacterias pueden
causar infección urinaria?___________________________________________________________________________________________________________________________
2. ¿Qué puede suceder cuando una mujer
tiene bacteriuria asintomática?_________________________________________________________________________________________________________________
3. ¿Por qué la mujer es más
propensa a la ITU?_________________________________________________________________________________________________________________________
4. ¿Qué medidas se debe seguir para
evitar las ITU?______________________________________________________________________________________________________
5. Investiga qué grupo de edad tiene mayores
casos de ITU en los tres hospitales de Ica__________________________________________________________
OBSERVACIONES
Dibuja lo que observaste en la
prácticaCONCLUSIONES:
________________________________________________________________________
Práctica Nº 08
Nombre del Alumno:_________________________________
Grupo______Profesor de Laboratorio____________________________
Calif:________PRÁCTICA
Nº 09Control de
los microorganismos: el antibiogramaOBJETIVO:
El alumno manejará algunas técnicas
para poner de manifiesto la actividad de los
antibióticos sobre el crecimiento
microbiano.MATERIAL:
Placas de petri con medios de cultivo
Mueller-Hinton.Asa bacteriológica
Mechero
Sensidiscos (antibiogramas)
Fenol al 5%
Cultivo de en caldo nutritivo de 18 horas de
Pseudomonas aeruginosaCultivo de 18 horas Staphylococcus
aureus en manitol sal AgarCultivo de 18 horas de Salmonella typhi
en medio Mac Conkey
INTRODUCCIÓN
ANTIBIÓTICOS
Son sustancias capaces de destruir y eliminar los
microorganismos causantes de una infección producida
por bacterias (faringitis, bronquitis, otitis,
neumonía, amigdalitis, etc). No son eficaces cuando la
infección es producida por virus (gripe).Cada tipo de antibiótico será efectivo
para destruir una clase de microorganismos en función
de su modo de actuación. Se les llama
antibióticos de amplio espectro a los que son
efectivos frente a un gran número de agentes
microbianos, los microorganismos causantes de la
infección son capaces de desarrollar resistencias al
antibiótico de manera que este no será eficaz
para eliminarlos. Cada año se investiga creando nuevos
antibióticos eficaces para las formas microbianas
resistentes a sus anteriores tratamientos. Se deben usar
siempre bajo prescripción médica.Existen pruebas (antibiogramas) que determinan el
antibiótico más eficaz para cada
infección, pero normalmente se sigue un protocolo de
actuación de los antibióticos de
elección para cada tipo de infección. Es el
médico el profesional que juzga la infección
existente y el antibiótico eficaz para su
tratamiento.Los antibióticos siempre se deben tomar bajo
prescripción médica y cumplir el tratamiento
completo. El incumplimiento del tratamiento puede dar lugar a
recaídas que precisarán el tratamiento con otro
tipo de antibiótico por haber desarrollado resistencia
al primeroMODO DE ACCION DE LOS
ANTIBIÓTICOSInhibición de la síntesis de la
pared celular.Alteración sobre la membrana
citoplásmica.Inhibición de la síntesis
proteica.Bloqueo de la síntesis de los
ácidos nucleicos.
ANTIBIOGRAMAS
Para estudiar la sensibilidad de un microorganismo
por técnicas de difusión se dispone de dos
sistemas, el de discos de papel impregnados con el
antibiótico y las tabletas, consistentes en una
suspensión del antibiótico liofilizada y
comprimida en material inerte. Los fabricantes recomiendan
conservar los discos a –20 °C para largos periodos
o entre 2 y 8 °C si se utilizan en el plazo de una
semana. Por el contrario, las tabletas se han considerado
más estables, pudiéndose almacenar a
temperatura ambiente y manteniendo su actividad más
tiempo que los discos .Por lo que respecta a la temperatura
de conservación, al comparar para cada
antibiótico los diámetros de los halos de
inhibición de los discos conservados entre 4 y 6
°C con los conservados a temperatura ambiente no se
encontraron diferencias significativas a lo largo de todo el
estudio; tampoco se encontraron diferencias al comparar los
halos de las pastillas conservadas entre 4 y 6 °C con las
conservadas a temperatura ambiente, de modo que tanto los
antibióticos que permanecieron estables durante el
tiempo del estudio como los que disminuyeron su actividad lo
hicieron de modo paralelo a ambas temperaturasPROCEDIMIENTO:
A) PREPARACIÓN DE LAS SUSPENSIONES
MICROBIANASSuspende la cepa bacteriana en agua destilada
logrado obtener una turbiedad del N° 10 del
nefelómetro de Mac- Farland. En caso de no tener el
nefelómetro solo ve la turbiedad a manera de
suspensión.B) ACTIVIDAD DE LOS ANTIBIÓTICOS EN
DISCOMarca 3 placas Muller-Hinton, o Agar nutritivo
con el nombre de la cepa S. aureus,
Salmonella typhi y otra con Ps.
aeruginosa.Toma con un hisopo diferente las muestras que
fueron preparadas en el inciso A de este procedimiento y
siembra las placas rotuladasQuema el hisopo y deséchalo.
Coloca los discos individuales sobre las placas
y presiona ligeramente los discos contra la
gelosaIncuba las placas a 37ºC durante 24
horasMide el diámetro de los halos de
inhibición del crecimiento producidos por cada
antibiótico y anota los resultados


C) DETERMINACIÓN DE INHIBIDORES EN LA
LECHEPrepara medio de cultivo Muller-Hinton, a
40ºCAñade 0.5 ml de B. subtilis
obtenido de un cultivo de 18 horas en caldo
nutritivo.Echa 15 ml del medio de cultivo ya enfriado a
40ºC y distribuye en forma
homogéneaDeja que solidifique.
2. Toma una muestra de leche y calienta en
baño María a 80ºC durante 3 minutos
exactamente, enfría bruscamente la leche en un
baño con hielo3. Impregna un disco de papel filtro con la leche
fría, sécalo ligeramente y con unas pinzas
esterilizadas deposita en el centro de la placa de petri
preparada anteriormente4. Incuba la placa de 18 a 20 horas a 37ºC y
observa las zonas de inhibición causadas por los
antibióticos sobre B. subtilis.5. Si la muestra de leche contiene
antibióticos, alrededor del disco se formará un
halo, el cual indica la inhibición de microorganismos
y presencia de antibióticos en concentraciones
superiores a las permitidasCUESTIONARIO
1. ¿Qué función tienen los
antibióticos?_____________________________________________________________________________________
2. Explica la acción de los
antibióticos en la inhibición de la
síntesis de proteínas bacterianas_____________________________________________________________________________________________
3. Menciona dos causas del porque los
microorganismos pueden llegar a hacerse resistentes a los
antibióticos______________________________________________________________________________________
4. Señala 3 antibióticos que
actúan sobre la pared celular bacteriana_____________________________________________________________________________________
5. De qué fuentes se obtienen los siguientes
medicamentos: estreptomicina, eritromicina, cefalosporina y
cloranfenicol_______________________________________________________________________________________
6. Según los resultados de tu
práctica. ¿Qué medicamentos puedes
utilizar para destruir y eliminar a Staphylococcus y
Escherichia coli:__________________________________________________________________________
7. Investiga que tipo de enfermedades pueden
ocasionar los microorganismos estudiados en la
práctica________________________________________________________________________________________
8. ¿Cuál es la acción
farmacológica de los siguientes medicamentos:
cloranfenicol, penicilina, cefalosporinas, gentamicina,
ácido nalidíxico?
__________________________________________________________________________________________9. ¿Qué finalidad tiene el lavar el
material que se empleará en la realización de
prácticas de microbiología?_______________________________________________________________________________________
10. ¿Por qué se recomienda que la
temperatura del lavado del material sea entre 40ºC y
50ºC?_____________________________________________________________________________________
11. ¿Qué finalidad tiene el empacado
antes de la esterilización?_______________________________________________________________________
12. ¿Qué desventaja tiene el utilizar
la esterilización por calor seco?____________________________________________________________________________________
13. ¿Cómo actúa la
radiación ultravioleta en los
microorganismos?___________________________________________________________________
14. ¿Cuál es el proceso de
esterilización de los materiales sintéticos que
se utilizan en los hospitales?_______________________________________________________________________________
15. ¿Cómo actúa el proceso de
desecación en los microorganismos?_________________________________________________________________________________________
16. ¿A qué condiciones de temperatura
y presión se destruyen todas las formas vegetativas y
esporas?_____________________________________________________________________________________
17. ¿Cómo actúa la
esterilización por calor húmedo en los
microorganismos?_______________________________________________________________________________________________
18. ¿Qué es DAN y cuáles son
sus ventajas y desventajas?_________________________________________________________________
OBSERVACIONES
Realiza dibujos de los resultados obtenidos a las 24
horas de incubaciónCONCLUSIONES
____________________________________________________________________________________________________
Práctica Nº 09
Nombre del Alumno:_________________________________
Grupo______Profesor de
Laboratorio_______________________________
Calif:______PRÁCTICA
Nº 10Estudio
serológico: antígenos
febrilesOBJETIVO:
Describir la acción antígeno
– anticuerpo en casos infecciososAplicar la reacción de Widal en la
identificación de pacientes con
tifoidea.Interpretar los resultados de la prueba de
Widal
MATERIAL
Sangre venosa
Set de antígeno febriles
Micropipetas
Láminas excavadas
INTRODUCCION
Antígenos Febriles es un término
referido a un grupo de suspensiones bacterianas,
representativo de un número de bacterias
patógenas para la especie humana y responsables de la
aparición de infecciones (brucelosis, salmonelosis y
ciertas rickettsiosis) que cursan con un cuadro febril en el
huésped infectado. La mejor forma para establecer la
etiología de una enfermedad infecciosa es el
aislamiento e identificación del agente causal de la
misma. Sin embargo, estos medios de diagnóstico no son
siempre de fácil aplicación y es ahí
donde radica la importancia del uso de las suspensiones
bacterianas en la detección de los anticuerpos
presentes en el suero del paciente (método indirecto
de diagnóstico).En el diagnóstico clínico, los
resultados obtenidos con el uso de los Antígenos
Febriles deben ser considerados siempre en relación a
los hallazgos clínicos y otras pruebas de
laboratorio.Nuestra sangre consta de un líquido
amarillento denominado plasma. Cuando la sangre se coagula se
obtiene una porción acuosa a la cual se le denomina
suero. En esta porción están suspendidas
glucoproteínas, llamadas inmunoglobulinas o
"Anticuerpos", que son sintetizados en nuestro organismo.
Ante una exposición a una sustancia o
microorganismo extraño (Salmonella typhi en
este caso), un tipo de células llamadas Linfocitos B
(Inmunidad mediada por células) produce estos
anticuerpos en su forma unida a la membrana. Este anticuerpo
unido a la membrana constituye el receptor de
antígenos de la célula B. Los linfocitos B
secretan anticuerpos sólo tras su
diferenciación, inducida por la interacción del
antígeno con el anticuerpo de membrana de este tipo
celular. Esta interacción constituye la fase de
reconocimiento de la inmunidad. Aquellas partes de la
molécula que interactúan y que son reconocidas
con más frecuencia por los anticuerpos se denominan
"Determinantes antigénicos inmunodominantes" o
"epítopes".Los Linfocitos B se activan ante la presencia del
antígeno, se multiplican originando un clon de
células iguales y se diferencian en células
plasmáticas capaces de elaborar el mismo tipo de
Anticuerpo específico contra el antígeno. Los
linfocitos B no empiezan su diferenciación y
producción de anticuerpos hasta que no reciben la
"señal" de los linfocitos TH colaboradores.Cada molécula de Ig (inmunoglobulina)
está formada por 4 cadenas polipeptídicas que
en conjunto adoptan la forma de Y. En la molécula se
diferencian 3 zonas: la subunidad Fc (pie de la Y) y las dos
subunidades Fab (brazos de la Y) que son las que permiten el
acoplamiento al antígeno. Existen 5 tipos de
inmunoglobulinas humanas:IgG: Antibacterianas y antivirales. Favorecen la
fagocitosis.Ig A: presentes en las secreciones (mucus,
saliva, etc.). Evitan fijación virus.IgM: Activación del complemento y
precipitación de antígenos
solubles.IgE: Intervienen en procesos
alérgicos.IgD: Estimulan la producción de
anticuerpos por parte de los linfocitos B
ANTÍGENO (que engendra a su contrario):
Moléculas ajenas a un organismo, que son reconocidas
como tales y que desencadenan contra el organismo que las
presenta, una respuesta inmunitaria.La unión entre el antígeno y el
anticuerpo es específica: cada anticuerpo reconoce y
se une a un determinado antígeno. Su unión
puede provocar:Neutralización: se produce sobre toxinas
y virus. El anticuerpo se une al antígeno e impide
que se fije a las membranas celulares, neutralizando su
acción.Precipitación: se produce cuando el
antígeno se encuentra disuelto, de forma que la
unión antígeno-anticuerpo resulta insoluble
y precipita.Aglutinación: cada anticuerpo se une a
dos antígenos y el resultado es la
formación de un entramado de complejos
antígeno-anticuerpo aglutinados. Facilita la
acción de los fagocitos.Opsonización: estimula la acción
de los fagocitos.
Para esta prueba, en el laboratorio se utilizan
suero de conejo. El conejo fue previamente inmunizado
inyectándole la bacteria atenuada; su sistema inmune
crea anticuerpos contra las salmonellas, entonces se extrae
la sangre del conejo, y se purifica todo el contenido de
inmunoglobulinas; esto es en laboratorios con equipo y
métodos adecuados.PROCEDIMIENTO
MÉTODO DE PRUEBA RÁPIDA EN
PLACA.Al paciente se le realiza una venopunción,
extrayendo la sangre en un tubo sin anticoagulante y es
centrifugada por 10 minutos a 3000 revoluciones por minuto.
Se separa el suero el cual se utiliza para la
determinación de los anticuerpos.Marcar en una placa de vidrio correctamente
indicando el antígeno que se esté
usando:Tífico "O" – Salmonella typhi;
Antígeno somático, pH: 6.5 ±
1.0Tífico "H" – Salmonella typhi;
Antígeno flagelar, pH: 6.5 ± 1.0
NOTA: El reactivo así como los sueros, deben
alcanzar la temperatura ambiente para comenzar la
prueba.1. Deposita en sitios diferentes de la placa una
gota de suero (30 ul).2. Agita el antígeno a utilizar para tener
una suspensión uniforme.3. Añade 30 ul de la suspensión de
antígeno a cada una de los sueros. Se recomienda
utilizar pipetas automáticas (el gotero incluido
proporciona una gota de 30-40 ul).4. Mezcla el antígeno y el suero utilizando
un aplicador diferente para cada una de las cantidades de
suero.5. Gira la placa manualmente o utiliza un agitador
mecánico (120 rpm) durante 2 minutos.6. Realiza la lectura utilizando una fuente de luz
directa y observa la aglutinación
macroscópica.7. Se recomienda incluir controles Positivo y
Negativo.INTERPRETACIÓN DE LOS
RESULTADOSObservar la aglutinación con ayuda de una
lámpara.Cuando hay reacción positiva se repite la
técnica con diluciones las cuales se obtienen con el
uso de las siguientes cantidades del suero en la siguiente
forma:Mililitros de suero
Dilución
0.08
1:20
0.04
1:40
0.02
1:80
0.01
1:160
0.005
1:329
INTERPRETACIÓN.
El informe del resultado de la prueba se hace
tomando en consideración la dilución más
alta que se observe en la reacción positiva. En
tifoideas los anticuerpos llegan a tener títulos
diagnósticos hasta los 8 días después de
la fiebre.LIMITACIONES DEL PROCEDIMIENTO
1. Algunos sueros normales pueden dar un titulo de
1:20 a 1:40 y hasta 1:80 pero esto puede ser debido a
vacunaciones o alguna infección anterior. No siempre
se presenta producción de aglutininas en infecciones
bacterianas.2. Se pueden producir reacciones cruzadas de
aglutininas debido a vacunaciones para ciertas enfermedades.
La vacuna tífica puede producir aglutininas contra
antígenos Proteus.CUESTIONARIO
1. Menciones algunas
características del género
Salmonella.__________________________________________________________________________________
2. ¿Dónde se
localiza en antígeno "O"?__________________________________________________________________________________________
3. ¿Dónde se
localiza el antígeno "H"?___________________________________________________________________________________________
4. Menciona otros
métodos de laboratorio para el
diagnóstico de salmonelosis.________________________________________________________________________________________
5. Menciona algunas
propiedades generales del género Brucella.________________________________________________________________________________________
6. Esquematiza tus observaciones
CONCLUSIONES:
________________________________________________________________
Práctica Nº 10
Nombre del Alumno:_________________________________
Grupo______Profesor de Laboratorio____________________________
Calif:________PRÁCTICA
Nº 11El shock
anafilácticoOBJETIVO
Que el alumno conozca la fisiopatología y
síntomas de la anafilaxia inmediataMATERIAL
2 conejos adultos
2 jeringas hipodérmicas de 10
mlSolución al 5% de albúmina
bovinaSolución al 5% de albúmina de
huevoAlcohol
Algodón
INTRODUCCIÓN
Las reacciones anafilácticas constituyen una
urgencia clínica. Pueden conducir a una insuficiencia
respiratoria, shock y muerte súbita.La lista de causas potenciales de reacciones
anafilácticas es muy grande:Antibióticos.
Agentes diagnósticos y
quimioterapeúticas.Anestésicos.
Medicamentos.
Ciertos alimentos.
La anafilaxis es el resultado de la respuesta en dos
fases del sistema inmunitario a un antígeno
extraño:a) En la primera de ellas, el contacto inicial con
el antígeno determina la síntesis de una
inmunoglobulina IgE específico para ese
antígeno. A continuación, estos complejos
antígeno-anticuerpo IgE específico se fijan a
los mastocitos del tejido conectivo que rodean a los vasos
sanguíneos y a los basófilos que circulan por
la sangre. A partir de este momento la persona esta
sensibilizada al antígeno.b) La segunda fase se inicia cuando un
antígeno frente a la cual la persona ha desarrollado
sensibilidad logra penetrar nuevamente en su organismo a
través de la piel, el tracto digestivo, o las
vías respiratorias. La interacción del
antígeno y el anticuerpo IgE a nivel de los mastocitos
desencadena la liberación de una serie de mediadores
químicos. Entre estos mediadores figura la histamina,
sustancia que afecta numerosos tejidos y sistemas
orgánicos, determinando en definitiva la respuesta
fisiológica característica del paciente con una
reacción anafiláctica.La forma de aparición y la naturaleza de una
reacción anafiláctica dependen de diversos
factores:La vía por la que el antígeno
penetra en el organismo.La cantidad de antígeno
absorbido.La velocidad de absorción.
El grado de hipersensibilidad de la
persona.
Cuanto mas rápido se produce la
reacción mas grave suele ser esta y por tanto, es
importante reconocer los signos y síntomas de cara a
una reacción inmediata.Los signos y síntomas iniciales más
comunes de la reacción anafiláctica son de tipo
cutáneo, progresando típicamente desde prurito
y eritema difuso a urticaria generalizada y edema vascular
especialmente en los labios, párpados y lengua.
También el paciente puede referir mucho
calor.Los trastornos respiratorios se inician con
sensación de nudo en la garganta para seguir con
ronquera, tos o estornudos, disnea y estridor. La
úvula cuerdas vocales y parte posterior de la faringe
pueden aparecer tumefactas. A la auscultación, se
detectan sibilancias difusas.A partir de este momento el paciente corre grave
peligro por insuficiencia respiratoria por obstrucción
de las vías respiratorias altas o bajas. Una
complicación frecuente es el edema laríngeo. De
hecho, la causa inmediata mas habitual de fallecimiento en
los casos de reacción anafiláctica es la
asfixia secundaria a edema laringe y
broncoespasmos.Los problemas cardiovasculares cuando
aparecen durante una reacción anafiláctica,
pueden dividirse en dos etapas. En primer lugar, el volumen
plasmático disminuye de forma notable como
consecuencia de una dilatación vascular, y la
consecuente salida del líquido intravascular hacia el
espacio extravascular, así pues, se puede
observar:Hipotensión, shock.
El hematocrito puede ser mayor de lo normal como
resultado de una hemoconcentración.Alteraciones electrocardiográficas como
taquicardia, bradicardia e isquemia.
En la segunda fase de las complicaciones
cardiovasculares puede aparecer depresión
miocárdica.Entre las alteraciones metabólicas figura un
aumento de los niveles séricos de histamina, acidosis
láctica y depleción de los factores de
coagulación.Los trastornos digestivos suelen ser infrecuentes,
los signos y síntomas más habituales son
náuseas, calambres abdominales, vómitos y
diarrea intensa secundaria a los espasmos de la musculatura
lisa.La prioridad máxima es valorar inmediatamente
el estado respiratorio del paciente:Si ha dejado de respirar inicie
reanimación respiratoria.Si además carece de pulso, inicie
reanimación cardiorrespiratoria.Administrar oxigeno según
necesidades.Estar preparados para una intubación
endotraqueal.Si el edema laríngeo ha ocluido las
vías respiratorias, el medico efectuara una
traqueostomía de urgencia.Insertar una vía intravenosa.
PREVENCIÓN DE LA ANAFILAXIS
Preguntar siempre acerca de posibles alergias
cuando se elabore la historia del paciente.Aparte de citar los alergenos responsables
describa las características y la gravedad de las
reacciones.Destacar los antecedentes de alergia en la
gráfica y en le plan de cuidados del
paciente.Siempre que se deba administrar algún
medicamento que pueda desencadenar anfilaxis, preguntar
al paciente si ha presentado alguna reacción y
permanezca con el paciente y observar si aparecen
manifestaciones de rechazo.Tener cuidado con los medicamentos que son
familia de los medicamentos de los cuales el paciente es
alérgico (ANTIBIOTICOS). Por ejemplo los pacientes
con antecedentes de sensibilidad a las penicilinas no
deben ser tratados con cefalosporinas.Todo paciente con riesgo a anafilaxis debe de
ser advertido de la posible gravedad de este tipo de
reacciones. Enseñarle las precauciones que debe de
tomar.
PROCEDIMIENTO
a) Dosis sensibilizante
1. Una persona debe sujetar firmemente al conejo A y
lo mantendrá con la posición en declive y con
la cabeza hacia abajo.2. Introduce la aguja bajo la piel, luego,
levantando ligeramente la mano, debes forzar el paso de la
punta de la aguja a través de la capa muscular y el
peritoneo3. Luego de ello, inocula 2.5 ml de solución
de albúmina bovina.4. Haz lo mismo con el conejo B; pero, en este caso
inocula solución de albúmina de
huevo5. Deja en descanso a los conejos por espacio de 21
díasb) Dosis desencadenante
1. Inocula lentamente por vía cardíaca
3 ml de albúmina bovina al conejo A y al conejo
B2. Observa los resultados
CUESTIONARIO
1. ¿Cómo se diagnostica el shock
anafiláctico en una persona?__________________________________________________________________
2. ¿Qué tratamiento se debe dar en
estos casos?____________________________________________________________________________________________________________
3. ¿Qué tipos de hipersensibilidad
conoces? Descríbelos__________________________________________________________________________________________________________________
4. En la práctica. ¿Por qué se
hizo la primera inoculación a los conejos?________________________________________________________________________________________________________________
5. ¿Qué observaste cuando se hizo la
segunda inoculación a los conejos?______________________________________________________________________________________________________________
6. ¿A qué se debe ello?
_________________________________________________________________
OBSERVACIONES
Representa gráficamente lo que has observado
durante el desarrollo de la práctica.CONCLUSIONES:
________________________________________________________________________________
Práctica Nº 11
Nombre del Alumno:_________________________________
Grupo______Profesor de Laboratorio____________________________
Calif:________PRÁCTICA
Nº 12Estudio
parasitológicoOBJETIVO
Que el alumno conozca la morfología de las
diferentes estructuras de los parásitosMATERIALES
Materia fecal
Láminas portaobjetos
Láminas cubreobjetos
Palitos mondadientes
Solución lugol
Solución salina
fisiológicaMicroscopio
INTRODUCCIÓN
PARASITISMO INTESTINAL
Este término define la infección del
tracto gastrointestinal por organismos que se aprovechan de
los nutrientes del cuerpo humano donde cumplen su ciclo
vital. Existen muchos parásitos causantes de
síntomas en el ser humano. De una manera simplificada
podemos agrupar los parásitos intestinales más
comunes en dos grupos:1) Protozoarios (microscópicos):
Amebas, Giardia y Criptosporidium.2) Helmintos ("gusanos"): Oxiuro, Ascaris,
Tricocéfalo, Ancylostoma, Necator, Strongyloides y
Toxocara.El mecanismo de contagio varía dependiendo de
cada parásito. La mayoría de ellos se adquieren
al ingerir agua o alimentos contaminados con sus quistes o
huevos; otros penetran a través de la piel, cuando la
persona o el niño camina descalzo sobre la
tierra.Los síntomas producidos por los
parásitos dependerán del organismo causante y
en muchas ocasiones no se presenta ninguna molestia. Los
parásitos protozoarios causarán síntomas
predominantemente intestinales (diarrea, distensión y
dolor abdominal); en cambio los helmintos, además de
producir los mismos síntomas, pueden ocasionar
molestias generales o en otros órganos y sistemas
(debilidad, palidez, pérdida de peso, deficiencias
nutricionales progresivas, anemia, tos crónica,
picazón anal).El diagnóstico se logra mediante la
visualización de quistes o huevos en exámenes
de heces, aunque ocasionalmente se pueden observar los
parásitos en estudios radiológicos intestinales
o en colonoscopias. En otras ocasiones se observan en las
heces o en las márgenes del ano.El tratamiento que se recomienda contra los
protozoarios se basa en el uso de diversos medicamentos,
tales como: Secnidazol, Tinidazol, Metronidazol y
Diodohidroxiquinolina.Para el tratamiento de las helmintos disponemos de
diversos anti-helmínticos de amplio espectro
efectivos, tales como: Albendazol, Mebendazol y Pirantel, que
permiten eliminar diferentes variedades de parásitos
con pocas dosis.En muchas ocasiones los síntomas se deben a
una infección mixta, bacteriana y parasitaria, por lo
que se requerirá tratamiento anti-parasitario y
antibiótico conjunto. En otras ocasiones son causados
por varios parásitos y requieren tratamientos con
medicamentos anti-protozoarios y anti-helmínticos
conjuntos.PROCEDIMIENTO
1. Para trabajar con materia fecal es recomendable
que utilices mascarilla y guantes
quirúrgicos.2. En una lámina portaobjetos, coloca en uno
de sus extremos una gota de solución salina
fisiológica y en el otro extremo una de
lugol3. Utiliza un mondadientes y coge una
fracción de materia fecal4. Mezcla con la gota de solución salina,
formando una película delgada y homogénea. No
debes hacer frotices gruesos, porque no permiten
visualizar.5. Haz la misma operación mezclando con la
solución de lugol.6. Coloca una laminilla cada preparación,
cuidando de que no se formen burbujas7. Examina al microscopio a 10X y 40X
CUESTIONARIO
1. ¿Por qué elementos orgánicos
está formado la materia fecal humana?________________________________________________________________
2. Para diagnosticar protozoarios ¿Qué
debes encontrar en la muestra de estudio?____________________________________________________________________________________________________________
3. Para diagnosticar helmintos ¿Qué
debes encontrar en la muestra de estudio?__________________________________________________________________________________________________________________
4. En la práctica. ¿Por qué se
hizo la primera mezcla en solución salina
fisiológica y no en lugol?________________________________________________________________________________________________________________
5. ¿Qué estructuras de
parásitos observaste en la práctica?______________________________________________________________________________________________________________
OBSERVACIONES
Representa gráficamente lo que has observado
durante el desarrollo de la práctica.


CONCLUSIONES:
__________________________________________________________
Práctica Nº 12
Nombre del Alumno:_________________________________
Grupo______Profesor de Laboratorio____________________________
Calif:________PRÁCTICA
Nº 13Estudio
parasitológico: protozoarios
intestinalesOBJETIVO
Que el alumno conozca la morfología de los
trofozoitos y quistes de los protozoariosQue sepa diferenciar los diferentes estadios de los
protozoariosMATERIALES
Materia fecal diarreica
Materia fecal fresco de cerdo
Láminas portaobjetos
Láminas cubreobjetos
Palitos mondadientes
Solución lugol
Solución salina
fisiológicaLáminas con preparados permanentes de:
Entamoeba histolytica, Giardia lamblia, Balantidium
coli, Cryptosporidium sp.Microscopio
INTRODUCCIÓN
Los protozoarios son organismos unicelulares. No son
visibles al ojo desnudo pero pueden ser vistos bajo el
microscopio. Un espécimen de excremento fresco es
requerido para encontrar a estos parásitos.El ciclo de vida
de los protozoarios es complicado. Básicamente, la
infección resulta de la ingestión en forma de
quiste u ooquiste). Los quistes invaden el recubrimiento de
los intestinos donde maduran a formas adultas y son expelidos
en las heces. Bajo condiciones favorables se desarrollan a la
forma infecciosa.Algunos absorben el alimento a través de sus
membranas celulares. Otros, como las amibas, rodean el
alimento y lo engullen. Otros tienen aberturas llamadas poros
bucales, con los cuales barren el alimento. Todos los
protozoarios digieren su alimento dentro de compartimientos
similares a estómagos llamados vacuolas.Las amibas son células muy fluidas que se
movilizan extendiendo partes de sus células como
seudópodos o "pies falsos". Otros protozoarios como
Giardia se impulsan agitando estructuras llamados flagelos
similares a pelos largos. Otros, como Balantidium, nadan
batiendo proyecciones similares a pelos cortos llamados
cilios en un patrón rítmico similar al que
producirían muchos minúsculos remos.La gran mayoría de protozoarios no hacen
ningún daño. Pero, sí hay algunos que
causan enfermedad. Un tipo de amiba, Entamoeba
histolytica, que puede vivir en el intestino humano se
alimenta de las células sanguíneas rojas y
causa disentería. El protozoario parásito
Cryptosporidium parvum afectó a 400.000
personas en Milwaukee cuando contaminó el agua del
acueducto en 1993. Otra amenaza protozoaria más
conocida es la Giardia lamblia, que causa diarrea y
mal absorción intestinal.PROCEDIMIENTO
1. No olvides de usar mascarilla y guantes
quirúrgicos.2. Para que prepares las muestras en fresco de
materia fecal diarreica y del cerdo, sigue el mismo
procedimiento de la práctica anterior.3. Examina al microscopio a 10X y 40X
4. Ahora, observa lo que te muestra el profesor en
los microscopios, si no puedes verlo nítidamente acude
sólo al tornillo micrométrico y gradúa
el espécimen5. Observa el trofozoito de E. histolytica,
e identifica la forma, el ectoplasma, endoplasma, las
vacuolas y el núcleo.6. Haz la misma observación con los
trofozoitos de Giardia y Balantidium.7. Cuando observes los quistes de los 3
protozoarios, incide en su forma y el número de
núcleos. Ahora, observa el ooquiste de
Cryptosporidium.CUESTIONARIO
1. ¿En qué se diferencia el trofozoito
de E. histolytica que es patógena, con el
trofozoito de E. coli, que es comensal?________________________________________________________________
2. ¿Por qué se dice que
Cryptosporidium es un parásito emergente?_____________________________________________________________
3. Se dice que Giardia lamblia causa el
síndrome de mal absorción ¿A qué
se debe esta afirmación?__________________________________________________________________________________________________________________
4. ¿Qué diferencia(s) existe(n) entre
un quiste y un ooquiste?________________________________________________________________________________________________________________
5. Balantidium es causante de una zoonosis
¿Por qué se dice así?______________________________________________________________________________________________________________
OBSERVACIONES
Representa gráficamente lo que has observado
durante el desarrollo de la práctica.


CONCLUSIONES:
_____________________________________________________________
Práctica Nº 13
Nombre del Alumno:_________________________________
Grupo______Profesor de Laboratorio____________________________
Calif:________PRÁCTICA
Nº 14Estudio
parasitológico: protozoarios hemáticos,
tisulares y urogenitalesOBJETIVO
Que el alumno conozca la morfología de los
trofozoitos y formas evolutivas de los protozoarios
hemáticos y tisularesQue sepa diferenciar los diferentes estadios de
estos protozoariosMATERIALES
Viales con solución salina
fisiológicaUna paciente con tricomoniasis
vaginalLáminas portaobjetos
Lancetas estériles desechables
Hisopos estériles
Láminas con preparados permanentes de:
Trypanosoma cruzi, Toxoplasma gondii, Leishmania
braziliensis, Plasmodium vivax, Trichomonas
vaginalis.Microscopio
INTRODUCCIÓN
Trypanosoma cruzi es un protozoario
hemático, donde se encuentra en forma de
tripomastigote: tiene aspecto fusiforme, de unas 20 micras,
con un solo flagelo largo, membrana ondulante y presencia de
kinetoplasto que protusiona en el extremo opuesto al flagelo.
Es un parásito que requiere dos hospedadores para su
desarrollo completo, uno vertebrado (el hospedero definitivo)
y otro invertebrado (el vector). En la chinche ingresa el
parásito en forma de tripomastigote en el momento de
la succión, para adquirir -en el intestino medio- la
forma de epimastigote; finalmente, cuando alcanza la ampolla
rectal, recupera la forma de tripomastigote
metacíclico o infectivo. Ninguna de las formas de
tripomastigote se multiplica, mientras que epimastiogtes y
amastigotes lo hacen por fisión binaria.Las Leishmanias, son protozoarios que pertenecen a
la familia Trypanosomatidae. Morfológicamente todas
las especies son similares, con diferencias en el
comportamiento biológico, inmunológico, tipo de
enfermedad y distribución geográfica. En el
hospedero vertebrado afecta el sistema reticuloendotelial y
se presenta intracelular en forma de amastigote. Este es
ovalado o redondeado, inmóvil, de 2 a 5 micrones. El
núcleo es voluminoso, esferoidal y central y cerca
está el quinetoplasto, el cual se colorea intensamente
y tiene forma de barra, asociado a un rudimento de flagelo
que no se extiende fuera del parásito.Las cuatro formas de paludismo humano pueden ser tan
semejantes respecto a sus síntomas iniciales que
dificulten su diferenciación por
especies, sin estudios de laboratorio.
Aún más el patrón febril de los
primeros días de la infección
se asemeja al que se observa en las etapas
incipientes de otras enfermedades bacterianas,
víricas y parasitarias. Incluso demostrar la presencia
del parásito no significa obligadamente que el
paciente tiene paludismo (puede haber también fiebre
amarilla, de Lassa y otras más en sus comienzos). La
forma más grave, que el paludismo por P.
falciparum (terciana maligna), puede mostrar un cuadro
clínico muy variado que incluye fiebre,
escalofríos, sudores y cefalalgia, y evolucionar a
ictericia, defectos de coagulación, choque,
insuficiencia renal y hepática, encefalopatía
aguda, edema pulmonar y cerebral, coma y muerte. Es
causa posible de coma y otros síntomas del sistema
nervioso central como la desorientación y el delirio,
en cualquier persona que haya retornado, recientemente de una
zona tropical, El tratamiento rápido es esencial,
incluso en los casos leves, porque pueden aparecer en forma
repentina complicaciones irreversibles; en los niños
no tratados y en los adultos no inmunes la tasa de letalidad
excede considerablemente del 10%.Examen de sangre
La preparación de buenas extensiones
sanguíneas dependerá en gran medida de la
pulcritud de los portaobjetos, así como del resto del
material analítico, que debe de estar perfectamente
lavado en alcohol y secado, antes de preparar la
extensión. Para preparaciones permanentes se debe
utilizar material nuevo.
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |